Резекция тонкой кишки понос
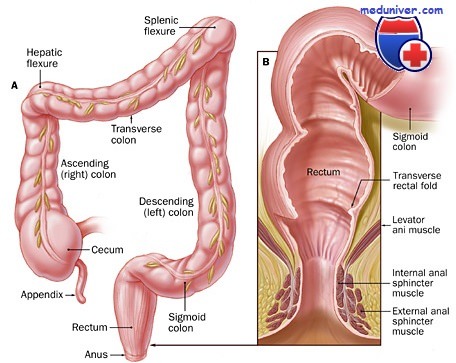
Синдром короткой кишки после операции на кишечнике. СтадииРезекция значительного объема тонкой кишки может привести к развитию синдрома мальабсорбции. Как правило, резекция тощей кишки переносится лучше, чем подвздошной. Резекция значительной части тощей кишки может привести к непереносимости лактозы, что, однако является саморазрешающимся процессом. Резекция дистального отдела подвздошной кишки часто ведет к дефициту витамина В12, солей желчных кислот с последующим снижением всасывания жиров. Кроме того, при резекции подвздошной кишки нарушается «тормозной механизм подвздошной кишки», вследствие чего снижается время прохождения пищи по кишечной трубке. Это может вызвать развитие профузной диареи и выраженного нарушения электролитного баланса. В уменьшении объема стула важную роль играет также илеоцекальный клапан, который замедляет прохождение пищи по кишечнику. После резекции кишечника вследствие снижения всасывающей поверхности тонкой кишки развивается синдром короткой кишки. В этот симптомокомплекс входят диарея, метаболический ацидоз, снижения уровней Са2+, Mg2+, Zn2+, дефицит витамина В12, железа, жирорастворимых витаминов, нарушение всасывания углеводов, белков, жиров, гиперсекреция желудочного сока, образование холестериновых камней в желчном пузыре и оксалатных камней в почках, выраженная дегидратация. Раньше синдром короткой кишки определяли как результат резекции более 50% тонкой кишки. В последнее время «синдромом короткой кишки» называется нарушение всасывания у взрослых пациентов, связанное с оставлением менее 200 см тощей и подвздошной кишки. Доля травматических повреждений у молодых людей с синдромом короткой кишки составляет 8%. Развитие синдрома короткой кишки включает три стадии: Острая стадия начинается в ближайшем послеоперационном периоде и может длиться 1-3 месяца. Эта стадия характеризуется снижением всасывания практически всех макро- и микроэлементов. При наличии стомы отделяемое из нее может превышать 5 л/сутки в течение первых дней после обширной резекции кишечника. Внутривенное введение больших объемов жидкости и электролитов проводится с целью предотвращения угрожающего жизни обезвоживания и электролитного дисбаланса.
Адаптация кишечника, проявляющаяся улучшением всасывания веществ в кишечнике, начинается в подострой стадии. Этот адаптационный процесс, длящийся месяцы и годы, заключается в дилатации оставшегося участка кишки, улучшении транспортной функции клеток и увеличении времени прохождения пищи по кишечнику. Адаптация кишечника может быть опосредована факторами роста и питательными веществами, в частности, гормоном роста человека, инсулиноподобным фактором роста, эпидермальным фактором роста, трансформирующим фактором роста и глюкагоноподобными пептидами. Для обеспечения питательными веществами из просвета кишечника с целью адаптации необходимо перейти на энтеральное питание. Согласно результатам недавно проведенного исследования, применение гормона роста, глютамина и питательных веществ для улучшения адаптации кишечника привело к выраженному снижению числа молодых пациентов с синдромом короткой кишки, нуждающихся полностью в белковой пище. Разнообразие хирургических методов, направленных на снижение времени продвижения пищевого комка по кишечнику и/или на увеличение длины кишечника имели ограниченный успех в лечении синдрома короткой кишки. Восстановление непрерывности оставшейся части толстой кишки может быть целесообразным в том случае, если толстая кишка возьмет на себя функцию всасывания путем использования энергии при расщеплении коротких жирных кислот и увеличения времени продвижения пищи, особенно при сохранившемся илеоцекальном клапане. Однако требуется по крайней мере, около 1 м оставшейся части тонкой кишки для предотвращения диареи и перианальных осложнений. К другим процедурам относятся хирургическое сужение дилатированного нефункционального сегмента кишечника и операции по удлинению кишки. К последним достижениям хирургического удлинения кишечника относится последовательная продольная энтеропластика. Трансплантация кишечника является последней альтернативой для пациентов, не способных к компенсации и адаптации после резекции кишечника. Трансплантация кишечника может быть также предложена пациентам, находящимся на полностью белковой пище для поддержания массы тела, а также у пациентов с невозможностью парентерального питания вследствие ограничения доступа для внутривенного введения веществ или заболеваний печени. Отдаленные коэффициенты выживаемости у пациентов после трансплантация кишечника в результате его травмы были одинаковыми по сравнению с пациентами без травматических повреждений. История повреждений живота богата интересными вопросами и важными наблюдениями. Уместно вспомнить любопытное издание военного времени «Ранения живота в Ливийской пустыне» Ogilvie Wh., 1944. Примечательно, что смертность при отрицательной эксплоративной лапаротомии составляла 23,8%, в то время как при резекции кишечника с формированием анастомоза вследствие повреждения тонкой кишки смертность была 42,8%. Представленные результаты по сравнению с современными ожидаемыми показателями заболеваемости и смертности в военной и гражданской хирургии являются поразительными. Это историческое знание дает весомые виды на будущее. Откровенные статистические данные и занимательный стиль работы Ogilvie заслуживают внимания всех, кто интересуется историей ранений живота. – Также рекомендуем “История лечения травм двенадцатиперстной кишки, поджелудочной железы. Этапы” Оглавление темы “Травма кишечника, поджелудочной железы”:
|
Источник
Синдром короткой кишки. Классификация синдрома нарушенного пищеварения
С развитием хирургии и анестезиологического пособия число перенесших обширные резекции тонкой кишки неуклонно растет. Однако качество их жизни низкое и напрямую зависит от структуры оказания и организации нутриционной поддержки. Больные после обширных резекций тонкой кишки в зависимости от последствий операции и функциональных нарушений, влекущих за собой нарушения нутритивного (метаболического) статуса вследствие малабсорбции, разделяются на три группы:
– больные с укорочением тонкой кишки до 2 м (адаптируемая культя кишки от 50 см до 2,0 м);
– больные с суперкороткой кишкой (длина культи менее 50 см, вплоть до 15—35 см),
– больные после больших резекций (с остатком кишки более 2 м).
Клинические проявления последствий обширных резекций тонкой кишки обозначаются термином «синдром короткой кишки» (СКК) и зависят напрямую как от объема резекции, так и от ее уровня. Обусловлены эти проявления главным образом выпадением функций удаленного участка кишечника (гидролитической, всасывательной, секреторной, транспортной). Приводимая ниже схема топографии всасывания нутриентов пищи иллюстрирует одну из возможных причин непоступления тех или иных питательных компонентов из энтеральной среды в кровь в зависимости от уровня резекции.
Во многом нарушения гидролитической обработки пищевых веществ обусловлены выпадением ферментной активности того или иного отдела тонкой кишки, нарушением преемственности энзимной обработки поступающего рациона, нарушениями структуры полостного гетерофазного гидролиза нутриентов вследствие изменения условий флокулообразования, а также нарушением гомеостатирования энтеральной среды после обширных резекций тонкой кишки (особенно верхних ее отделов).
Эти нарушения также отражаются в смежных клинических признаках. Так, при уровне резекции с участием двенадцатиперстной кишки, помимо трофологической недостаточности, гипопротеинемии, анемии (преимущественно фолиеводефицитной), преобладает остеопороз.
При обширных резекциях тощей кишки выражены истощение, гипопротеинемия, гиповитаминозы, дефициты калия, в меньшей степени — натрия. Вследствие недостатка гуанилина (тонкокишечного гормона) нарушается секреция хлоридов.
Обширная резекция подвздошной кишки чаще сопровождается нарушением абсорбции жидкой части химуса с развитием диареи, анемией по типу Аддисон—Бирмера ввиду отсутствия всасывательной поверхности для витамина В12 и стеатореей из-за снижения абсорбции липидного компонента. Кроме того, отсутствующие вследствие резекции подвздошной (также двенадцатиперстной) кишки или присутствующие в недостаточном количестве S-клетки, влияющие с помощью секретина на стимуляцию секреции жидкости и бикарбонатов поджелудочной железой и снижение секреции соляной кислоты, способствуют нарушению гидролитической обработки рациона.
Однако в большинстве случаев суперкороткая культя остается со стороны проксимальной части кишки, что при наличии толстого кишечника позволяет в определенном проценте случаев достигать положительной динамики в коррекции метаболических нарушений смешанным или даже оральным путем.
В любом случае при синдроме короткой кишки развивается синдром вторичной энтеральной недостаточности. Он может вызываться различными причинами, в зависимости от которых преобладает та или иная форма малабсорбции. При обширных резекциях кишечника преобладает энтерогенная форма, однако при сочетанной патологии (наиболее часты сочетания с заболеваниями поджелудочной железы, печени) может развиваться синдром нарушенного всасывания (СНВ) смешанного типа.
В любом случае в развитии клинических проявлений синдрома короткой кишки определяющим патогенетическим механизмом служит различная выраженность синдрома нарушенного пищеварения (СНП) и синдрома нарушенного всасывания (СНВ).
В отличие от динамики всех тяжелых нарушений метаболизма непосредственно после оперативных вмешательств при СКК диагностируется стадия декомпенсации, которая длится минимум 2—3 недели, когда больной страдает диареей с массивной потерей жидкости и электролитов (вплоть до нарушения сердечного ритма, судорожного синдрома, коллапса), выраженным катаболизмом вследствие нарушения усвоения белково-энергетических компонентов, поступающих через пищеварительный тракт. В зависимости от объема резекции трофологическая недостаточность может быть выражена вплоть до кахексии и развития полиорганной недостаточности.
При благоприятном течении адаптивных процессов спустя 6—12 месяцев может наступить период восстановления (стадия субкомпенсации утраченных функций кишечника), когда число дефекаций уменьшается до 3—5 в день, снижается объем каловых масс, намечается тенденция к нормализации массы тела.
Спустя 1—1,5 года при достаточном развитии компенсаторных процессов наступает стадия относительной компенсации (замедляется пассаж химуса, активируются процессы пищеварения и всасывания, сохраненные соседние участки пищеварительной трубки адаптивно гипертрофируются, беря на себя функции утраченных отделов тонкой кишки).
Ввиду повышенной нагрузки на биохимические циклы межуточного обмена в этот отдаленный период возможно формирование камней в желчном пузыре (нарушение энтерогепатической циркуляции), камней в почках (вследствие ги-пероксалатурии), пептических язв анастомозов, желудка и двенадцатиперстной кишки (из-за гиперсекреции желудочного сока), появление мегалобластиче-ского типа кроветворения (ввиду нарушения всасывания витамина В12). Возможно возникновение сосудистой патологии, нарушений ритма сердца вследствие недостаточности дипептидаз (особого внимания требуют больные, принимающие ингибиторы АПФ — ангиотензинпревращающего фермента, который ингибирует конвертирующий энзим — пептидил-дипептидазу, превращающую ангиотензин I в ангиотензин II и инактивирующую брадикинин — сильный вазодилятатор). Возможен остеопороз из-за недостаточности всасывания факторов, участвующих в работе свертывающей системы крови (витамина D, ионов Са и др.).
Выраженность СНП и СНВ, наличие сочетанной патологии определяют тяжесть состояния больного, учитываемую чаще по шкалам APACHE II и III.
Особого внимания заслуживают больные с суперкороткой тонкой кишкой и сочетанной тонкотолстокишечной обширной резекцией.
У больных с суперкороткой тонкой кишкой все метаболические расстройства крайне выражены и в раннем периоде после операции поддаются только парентеральной коррекции. В последующем возможно сочетанное парентерально-сипинговое или перентеральное в сочетании с частичным пероральным. При этом лучший эффект оказывают олиго-мономерные смеси или составы, предварительно обработанные ферментами щеточной каймы и вследствие этого легко всасывающиеся в сохраненных верхних отделах тонкого кишечника, химусоподобные смеси.
Такие больные даже после перевода на специализированные диеты вынуждены периодически (примерно 1 раз в 2—3 месяца) проводить внутривенную коррекцию в условиях стационара.
Постепенно методом выбора для больных с ультракороткой тонкой кишкой, практически несовместимой с жизнью, становится трансплантация (показания к трансплантации — в приложениях), после которой в 90% случаев удается перевести больных на обычное питание и вернуть к нормальной жизни.
Следует отметить, что значительный процент больных с ультракороткой кишкой до трансплантации вынужден находиться практически на полном парентеральном питании. Однако, как известно, полное парентеральное питание (ППП), проводимое в течение более трех месяцев, в свою очередь, может привести к поражению печени.
«Бактериальный и грибковый сепсис вызывает холестаз и является показанием к ППП. Избыточный рост бактерий в кишечнике и введение катетера для длительных внутривенных вливаний предрасполагает к развитию сепсиса..» (Шифф,2010).
Уже в течение ППП, продолжающегося более 2—3-х недель, в биохимическх показателях, характеризующих функцию печени, наблюдаются некоторые отклонения от нормы (повышение активности ACT, АЛТ, ЩФ, уровня билирубина). В ряде случаев может развиться холестаз, акинезия желчного пузыря и, как следствие, постепенное формирование билиарного сладжа и желчно-каменной болезни. Для профилактики рекомендуют: метронидазол для снижения избыточного бактериального роста в кишечнике и урсодезоксихолевую кислоту для стимуляции желчеоттока.
Одновременно регистрируются гормональные сдвиги, служащие одним из механизмов развития жирового гепатоза.
Ряд авторов описывает морфологические изменения в печеночной ткани, полученной путем биопсии (главным образом, жировую инфильтрацию, обусловленную избыточным калоражем преимущественно за счет вводимой глюкозы). Макроскопически такая печень может выступать из-под края реберной дуги. Микроскопически выявляют отложение жира в клетках, охватывающее преимущественно перипортальные зоны, но в тяжелых случаях может распространяться на всю дольку.
Введение в структуру алиментационной терапии фармаконутриентов (лецитина и холина), по данным других авторов, способствуют уменьшению жировой инфильтрации печени.
Доказано также, что при длительном ППП развивается стеатогепатит с исходом в фиброз. Поэтому в конечном счете у таких больных следует рассматривать вопрос о трансплантации кишечника вместе с печенью.
Тяжелые метаболические расстройства наблюдаются и у больных, перенесших сочетанные обширные тонкотолстокишечные резекции. Расстройства чаще появляются вследствие тромбоза сосудов брыжейки (65%), распространенной формы (тип 2) болезни Крона (17%), тяжелых онкологических поражений.
В зависимости от объема резекции тонкой кишки, степени сохранности ее остаточной функции и сроков, прошедших с момента операции, а также уровня сохранности толстой кишки определяют тактику алиментационной реабилитации этой категории больных. Стандарт лечения больных с массивной резекцией тонкой кишки, разработанный в ЦНИИ гастроэнтерологии в 2007—2008 г., в последние годы существенно дополнен на основе следующих патогенетических подходов.
1. В основу лечения должен быть положен синдромный подход, отражаемый в алиментационно-волемическом диагнозе, позволяющем максимально точно определить алгоритм нутриционной поддержки.
2. Энтеральную алиментацию необходимо начинать с энтерального или перорального введения водно-электролитных или поляризующих растворов (это обеспечивает отмывание кишки и стимуляцию ее двигательной активности).
3. С учетом развивающегося синдрома кишечной недостаточности для интенсивного и пропорционального всасывания в культе тонкого кишечника, для наименьшей нагрузки на ее адаптивные возможности должны применяться смеси, легко усвояющиеся в кишечнике (т.е. аналогичные химусу по составу и соотношению компонентов, в т.ч.поли-, олиго- и мономеров). К этим смесям относятся отечественные препараты класса нутрихим (нутрихим-1А, нутрихим-1Б, нутрихим-2, витазим, нутрозим). Близкие к ним продукты — ренутрил (Франция), фрезубин (Германия).
4. При отсутствии химусоподобных составов допустимо применять сбалансированные растворы для зондового введения, но в разведении (вначале 1:2 с постепенным наращиванием калоража смеси за счет сгущения) малыми дозами с использованием преимущественно болюсной подачи.
5. При алиментационной реабилитации используют принцип постепенного нагнетания энергоемкости смеси.
6. Принципы лечения в разные сроки после резекции должны различаться по следующим позициям:
а) лечение в первый период после резекции главным образом должно быть направлено на коррекцию метаболических нарушений и восстановление гомеостаза;
б) во второй период развития синдрома короткой кишки назначают комплексное лечение, дополнительно направленное в т.ч. на предупреждение или устранение дисбактериоза;
в) в третий период (после стабилизации состояния) больной должен находиться под диспансерным наблюдением и в зависимости от объема резекции (последствия больших резекций — субкомпенсированный синдром короткой кишки, последствия обширной резекции — синдром короткой кишки или синдром суперкороткой кишки) и параметров алиментационно-волемического диагноза выбирается тактика.
К препаратам белково-энергетического действия при недостаточности тонкой кишки целесообразно добавлять фармаконутриенты. На функции кишечника оказывает влияние и значительное число фармакологических препаратов, одни из которых способны стимулировать пищеварительную функцию тонкой кишки, другие — всасывательную.
Коронтин (прениламин, дифрил) в суточной дозе 180 мг повышает активность инвертазы в сфере мембранного гидролиза и у-амилазы. При лечении преднизолоном возрастает ЩФ в дуоденальном соке, но снижается активность амилазы и липазы в зоне мембранного пищеварения. Метилпреднизолон повышает активность аминопептидазы в щеточной кайме тощей и подвздошной кишок. Эуфиллин (ингибитор фосфодиэстеразы) и индуктор микросомальных ферментов фенобарбитал стимулируют кишечные энзимы при их низкой активности. Галидор, трентал, симпатомиметик изоксуприн вызывают в той или степени повышение активности дисахаридаз тонкой кишки.
Известно также, что анаболические стероиды повышают гидролиз сахарозы (в среднем на 46%), а циметидин, повышая рН содержимого тонкой кишки у больных, перенесших резекцию подвздошной, способствует снижению преципитации желчных кислот в кишечнике и тем самым повышению солюбилизации жирных кислот и их более интенсивному всасыванию.
С помощью минералкортикоидов, эфедрина, Л-ДОФА можно стимулировать кишечную абсорбцию и тормозить кишечную секрецию. Тормозят секцию кишечника и альфа-адренергические препараты. Введение фармаконутрицевтиков в структуру нутритивной коррекции в зависимости от их механизма действия, по мнению современных исследователей, весьма целесообразно. Используя остаточную культю или дополнительные парентеральные введения препаратов, целесообразно применять антигипоксанты, корректоры кислотно-основного равновесия, препараты цикла Кребса, ферментную и другую симптоматическую терапию в соответствующих дозировках.
– Также рекомендуем “Показания к операции при ожирении. Рекомендации по питанию”
Оглавление темы “Питание при патологии желудочно-кишечного тракта”:
- Гомеостаз жидкостей организма. Оценка трофологического статуса
- Лабораторные исследования после резекции толстой кишки. Нутритивная коррекция
- Классификация синдрома гиперметаболизма-гиперкатаболизма. Алиментарно-волемический диагноз
- Синдром короткой кишки. Классификация синдрома нарушенного пищеварения
- Показания к операции при ожирении. Рекомендации по питанию
- Парентерально-энтеральное питание пациентов. Показания
- Коррекция белково-энергетической недостаточности (БЭН). Принципы
- Желудочно-кишечный тракт пожилых. Особенности
- Клиника, диагностика белково-энергетической недостаточности пожилых. Диагноз
- Питание при осложненном хроническом панкреатите на фоне цирроза печени. Рекомендации
Источник
